ПЦР, Cannabis sativa и продукты питания
05.03.2021 - 764 просмотраРазработка и валидация анализа ПЦР в реальном времени для обнаружения Cannabis sativa в продуктах питания
Научные отчеты объем 11 , Номер статьи: 4748 ( 2021 )
Статья опубликована 26 февраля 2021 г
В последнее время конопля с учетом ее полезного макро- и микрокомпонентного профиля, а также необходимости устойчивых источников растений, обусловленной ростом населения 1 приобрела все большее значение в качестве ценного пищевого ингредиента . В настоящее время постановлением Европейского парламента и Совета No. 1307/2013 2 сортам конопли, выращиваемым в Европе ( Cannabis sativa L. ), разрешено накапливать максимальное содержание ТГК (тетрагидроканнабинола) 0,2%. (В России - 0,1%)
Действительно, выращивание конопли было запрещено в нескольких странах Западной Европы в середине двадцатого века из-за ее психотропного потенциала 3.. Однако в начале двадцать первого века интерес к урожаю возродился; сначала рассматривались просто как прибыльный побочный продукт 4 , а впоследствии продавались в магазинах здорового питания как нишевый продукт, ценный для питания человека 3 . Высокие питательные качества семян конопли являются результатом хорошо сбалансированного состава макроэлементов, состоящего из 25–35% масла, 20–30% углеводов, 20–25% протеина с высокой степенью усвояемости и 10–15% нерастворимой клетчатки 5 , 6 , 7 . Кроме того, они содержат примечательный уровень минералов и витаминов, таких как витамин E, A и C 8 .
Чтобы еще больше проиллюстрировать качество семян конопли, следует обратить внимание на идеально сбалансированный состав жирных кислот конопляного масла.9 . Поэтому Монтсерран-де-ла-Пас исследовал профиль жирных кислот семян конопли с помощью газовой хроматографии. Они указали, что 76% всех жирных кислот являются полиненасыщенными, а по 12% - мононенасыщенными и насыщенными. Таким образом, 88% всех жирных кислот являются ненасыщенными; Линолевая (55%), α-линоленовая (16%) и олеиновая кислоты (11%) являются наиболее распространенными 6 .
Кроме того, Vonapartis et al. подтвердили высокое содержание ненасыщенных жирных кислот, изучив профиль жирных кислот десяти сортов конопли с помощью капиллярной газовой хроматографии, и уточнили, что они содержат в среднем 90% ненасыщенных жирных кислот. Соответственно, они подтвердили, что в большом количестве ненасыщенные жирные кислоты представлены линолевой кислотой (56,07%) и α-линоленовой кислотой (15,98%), и что основной мононенасыщенной жирной кислотой является олеиновая кислота (11,76%).10 . В
результате ценность жирнокислотного профиля конопляного масла определяется незаменимыми жирными кислотами линолевой и α-линоленовой кислотами, что приводит к благоприятному соотношению 3: 1 5 , 6 , 11 , 12 , что также было подтверждено Vanapartis. и другие. 10. В заключение, высокое количество α-линоленовой кислоты, высокое соотношение полиненасыщенных / насыщенных жирных кислот и, кроме того, соотношение ω-6 / ω-3 жирных кислот могут иметь благоприятные физиологические эффекты на питание человека. Кроме того, Multari et al. подтвердили, что конопля в виде муки также имеет ценный профиль макро- и микрокомпонентов со значительным содержанием белка 38,55 ± 0,32% (масс. / масс.) и, кроме того, является богатым источником нерастворимой клетчатки (25,49 ± 1,45% ( ж / ш)) 1. Таким образом, конопля является естественным источником растительного белка, содержащего все незаменимые аминокислоты, с одновременным отсутствием ингибирующих факторов, что является преимуществом перед соей в растительном и веганском питании.
Точно так же семена конопли используются для производства немолочных продуктов, таких как десерты, хлебобулочные изделия или растительные молочные напитки, и, таким образом, заменяют продукты из сои, которые, наоборот, должны импортироваться 13.и преимущественно генетически модифицированы. В результате конопля является экологически чистым и экологически чистым источником белка, пищевых волокон и ценных жирных кислот, который можно использовать в качестве ингредиента, не содержащего глютен, для обработки функциональных, полезных и менее аллергенных продуктов, чтобы удовлетворить потребности потребителей, заботящихся об окружающей среде и питании.
Следовательно, больше производителей пищевых продуктов могут использовать коноплю в качестве ингредиента в своих продуктах и приложить усилия, чтобы указать на различные полезные физиологические эффекты на питание человека. Поскольку в последние годы возрос интерес к изучению потенциального использования конопли в пищевых продуктах 14
Цель настоящего исследования - разработка и проверка конкретного метода ПЦР в реальном времени, который позволяет точно обнаруживать бесконечно малые следы конопли, чтобы реагировать на коноплю как на текущий и перспективный ингредиент пищи. Что касается безопасности пищевых продуктов, важно иметь действующие методы для проверки и гарантии подлинности пищевых продуктов с точки зрения защиты потребителей. На данный момент отсутствуют широко проверенные методы ПЦР, которые используются в рутинных анализах для надежного обнаружения конопли и обеспечения подлинности этих пищевых продуктов. Что касается перспективной оценки подлинности и фальсификации пищевых продуктов, этот подход представляет собой новинку в области пищевой аналитики.
Анализ нацелен на конкретную спейсерную последовательность ДНК в хлоропластах Cannabis sativa и обнаруживает 1,5 пг ДНК конопли, что эквивалентно 18 копий / мкл. В соответствии с очень низким LOD (0,00031 нг / мкл) метод позволяет обнаруживать коноплю даже при бесконечно малой концентрации загрязняющих веществ. Благодаря SNP в позиции 603, конопля может быть однозначно идентифицирована и отличаться от ее ближайшего родственника хмеля ( Humulus lupulus). Метод ПЦР не показал перекрестной реактивности с 39 из 46 протестированных видов растений. Низкой перекрестной реактивностью с шелковицей, крапивой, лавандой, васильком, вином, инжиром и хмелем можно пренебречь, поскольку значения Δ Ct> 14, а полученные значения Ct выходят за пределы порогового значения для положительной оценки ( Ct-значения ≤ 33). Более того, пригодность метода для определения конопли в качестве пищевого ингредиента была доказана путем анализа различных пищевых продуктов, таких как шоколад или печенье.
Подготовка образцов и выделение ДНК
Образцы семян
Составные образцы 5 семян конопли измельчали в пробирке Precellys на 2 мл, содержащейся в наборе для измельчения MK28 со стальными шариками 2,8 мм, с использованием гомогенизатора тканей Minilys (Bertin Technologies, Франция). ДНК экстрагировали с помощью набора NucleoSpin Plant II (Macherey-Nagel, Германия). На основании измеренной концентрации экстракты разбавляли до рабочей концентрации 5 нг / мкл для последующего анализа ПЦР.
Образцы продуктов питания и листьев
Образцы пищевых продуктов, описанные в таблице 2, измельчали и гомогенизировали с использованием ножевой мельницы Grindomix GM200 (Retsch, Германия). Впоследствии ДНК экстрагировали в соответствии с протоколом CTAB с использованием Custom-Kit системы экстракции нуклеиновых кислот Maxwell 16 FFS.(Промега, США). Перед экстракцией шоколад обезжиривали ацетоном и петролейным бензином. Образцы листьев, использованные для анализа перекрестной реактивности, были глубоко заморожены жидким азотом и гомогенизированы с использованием ступки. Впоследствии ДНК была извлечена аналогично образцам пищи. Для расчета концентрации ДНК в экстрактах ДНК измеряли поглощение при 260 нм с помощью спектрометра УФ / видимого света (QIAxpert System, Qiagen, Нидерланды). На основании измеренной концентрации экстракты разбавляли до рабочей концентрации 5 нг / мкл для последующего анализа ПЦР.
Праймеры и зонды
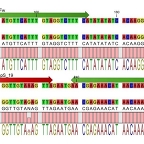
В начале исследования, следующий набор праймеров / зонд был разработан, чтобы целевым конопляной конкретной последовательность спейсера между TRNL 3'exon и TRNF геном в коноплях хлоропластов (рис. 5 а). Праймеры : Hemp_19Fw: TCC TTA TGT TCA TTT GTA GGT CTT TCA, Hemp_19Rv: GTG GTT TC TAA TTT GTT ATG TTT CTC GTT, зонд: HempS_19: NED -CCG GTT GTA AAG TTA- MGBNFQ . Длина ампликона составляет 122 пары оснований (п.о.). Оптимальные концентрации праймера и зонда (0,25 мкмоль / л на праймер и 0,25 мкмоль / л зонд) определяли путем разработки матрицы праймер / зонд; Результаты можно видеть на фиг. 5б. Схемы концентрации 2 и 3 обеспечивают наиболее подходящие кривые амплификации с оптимальными экспоненциальной и плато - фаза (рис. 5 б). По практическим соображениям для анализа ПЦР была выбрана схема концентрации 3, состоящая из 0,25 мкмоль / л на праймер и 0,25 мкмоль / л зонда. Праймеры Hemp_19Fw, Hemp_19Rv и зонд HempS_19 были сконструированы с использованием программного обеспечения Primer Express 3.0 (Applied Biosystems, США). Зонд помечен на 5'-конце репортерным красителем NED (ПЦР в реальном времени) или FAM (ddPCR), а на 3'-конце - нефлуоресцентным гасителем связывания с малой бороздкой (MGBNFQ). Оптимальные концентрации праймера и зонда (рис. 5).б; схема 3) определяли путем разработки матрицы праймер / зонд, сочетающей концентрации праймера 0,5 мкмоль / л и 0,25 мкмоль / л с концентрациями зонда 0,1 мкмоль / л и 0,25 мкмоль / л, соответственно.



 Разработка cайта
Разработка cайта